|
新版GMP-2010 “技术升级
|
ISO 14644系列相关条文
|
|
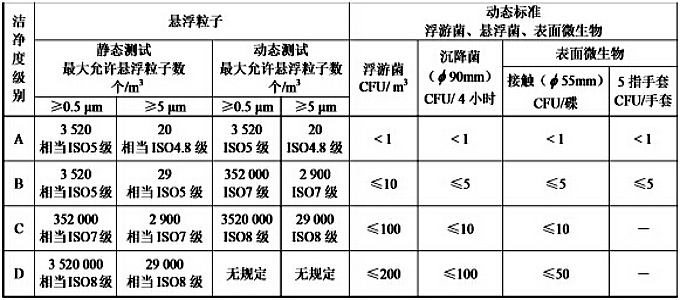
生产区的洁净区分为A、B、C、D 4个级别,各个区域 洁净度采纳G际标准ISO 14644-1,明确占用状态下不同关注粒径时的**大浓度限值。
|
ISO 14644-1技术概念: 关注粒径considerd;**大浓度限值 maximun concentration limit; 占用状态(空态as-built、静态at-rest、动态operational)。
|
|
测试方法参照ISO 14644-1 ● A级洁净区每个采样点的采样量不得少于1 m3。 ● **少采样点数:洁净室面积开方(修正为整数)GB/T 16292-201《医药工业洁净室(区)悬浮粒 子检测方法》中,**小采样点数推荐表应用时“操 作性” 差(应按统计学的要求)。
|
ISO 14644-1:● 关注粒径(**大粒子)**大浓度限值时,每个采样点要采集到足以检 测出不少于20颗粒子的空气量。采样点一次**少采样量:升(Cn,m为相关等级**大关注粒径时浓度限值个/m3)。● 采样点数量2~9个时,以各点的平均浓度计算总平均值、标准差和95%置信上限。
|
|
● 洁净区的设计必须符合相应的洁净度要求,包括 达到“静态”和“动态”的标准。 ● 对洁净区的悬浮粒子进行动态监测。
|
ISO 14644-2:● 设施的监测一般在动态下进行。● 证明持续符合粒子浓度限值的检测周期:≤ISO 5级,6个月;≥ISO5级,12个月; 风量、风速、压差**长检测时间间隔为12个月; 过滤器使用检测、气流可视检查、自净、隔离检测**长周期为24个月。
|
|
● 生产操作全部结束、操作人员撤出现场并经5~20分钟(指导值)自净后,洁净区的悬浮粒子应当达到“静态”标准。● B级区:动态为ISO 7级自净后,静态要达到ISO 5级。设计时按ISO 6级(换气次数60次/时左右) 设计。
|
ISO 14644-3 ● 自净检测是测定设施清除空气悬浮粒子的能力。● 仅对非单向流系统推荐采用,因为自净性能与受控区内循环风比例、送风与出风的几何位置、热条件和气流分布特性相关。 ISO 8级和ISO 9级不推荐此项检测。检测应在设施处于空态或静态时进行。● 自净性能由100:1自净时间(粒子浓度降低**0.01倍 初始浓度所需时间)或洁净度恢复率(粒子浓度随时间的变化速率)来表示。
|
|
药厂要求洁净厂房高效空气过滤器“逐台原位检漏”。 GMP-2010条文中并无明确规定。只是在GB/T 16292-2010《医药工业洁净室(区)悬浮 粒子的测试方法》中,“预先测试”要求进行HEPA的泄 漏测试。
|
ISO 14644-3:● “已装过滤系统检漏”是确认过滤系统安装正确,使用过程中无渗漏发生。只在“空态”或“静态”下进行。● 这项检漏滤材、过滤器边框、密封垫和支撑架在内的整个过滤系统;不要与过滤器 出厂时的效率检测混为一谈。● 通常采用气溶胶光度计扫描检漏:∆ 气溶胶采用DOP/DEHP邻苯二甲酸二辛酯,由于安全原因现采用DOS 癸二酸二 辛酯或DEHS 癸二酸二酯、PAO聚 烯油。∆ 气溶胶浓度10~100 mg/m3。浓度低于20 mg/m3检漏灵敏度欠佳;高于80 mg/m3长时间检测会过度污染过滤器。∆ 扫描速度为5 cm/s(使用3cm× 3cm正方形采样头时)。∆ 验收限值:当读数大于上风向气溶胶浓度的10-4(0.01 %),即认为存在渗漏。
|